|
Уважаемые посетители сайта, если Вы используете
информацию или фотографии данного сайта, то обязательно указывайте ссылку на
данный ресурс. |
|
|||
Содержание
Кристаллы
Выращивание кристаллов по истине увлекательное занятие и, пожалуй, самое простое, доступное и недорогое для большинства начинающих химиков, максимально безопасное с точки зрения ТБ, что немаловажно для тех, кто проводит эксперименты дома. Тщательная подготовка и выполнение оттачивают навыки в умении аккуратно обращаться с веществами и правильно организовывать план своей работы. Советская и современная литература по демонстрационному эксперименту зачастую охватывает этот раздел, но авторы, как правило, не всегда указывают на детали. Ниже я излагаю свою методику по выращиванию кристаллов, которой пользуюсь с 1997 года. Отнесёмся к данному опыту, как к любому химическому эксперименту, в котором также существует своя предварительная подготовка, стадии выполнения.
Рост кристаллов я бы разделил на пункты:
1. Естественный (образование кристаллов в природе);
2. Искусственный:
2.1. для научно-технических целей;
2.2. на занятиях экспериментальных, практических, внеклассных работ;
2.3. случайный рост кристаллов (рис. 1) – результат был достигнут непреднамеренно, опыт прошёл без контроля экспериментатора, имели место неучтённые факторы или условия, имели место дополнительные химические и (или) физические процессы (пример: испарение растворителя через треснувшую пробку, пролонгированное окисление вещества в растворе способствовало кристаллизации другого и др.);

|
а |
б |
в |
г |
Рис. 1. Примеры, иллюстрирующие случайный рост кристаллов:
(а,б,в) треснутая крышка способствовала постепенному испарению воды, поскольку вещество оказалось не очень гигроскопичным, оно выкристаллизовалось (это могут быть и KI, Pb(NO3)2 и др.)
(г) окисление бензальдегида кислородом воздуха со временем дало бензойную кислоту, которая постепенно выкристаллизовалась из него в виде бесцветных игл:
C6H5CHO + [O] = C6H5COOH
А следующая фотография
иллюстрирует пример, так называемой «промышленной забывчивости». Так получилось
что в
 Выращивание
кристаллов физико-химический процесс.
Выращивание
кристаллов физико-химический процесс.
Растворимость веществ в любых растворителях можно отнести к физическим явлениям со следующей позиции: происходит разрушение кристаллической решётки, теплота при этом поглощается из окружающей среды (иногда так сильно, что это можно ощутить тактильно, например, при растворении нитрата NH4NO3 или роданида аммония NH4SCN, иодида калия KI, красной кровяной соли K3[Fe(CN)6] и др.). Это растворение называется эндотермическим. Другой физический процесс – диффузия. Возьмите несколько кристалликов марганцовки и киньте в высокий цилиндр. Вы увидите, как вокруг них появятся розовые завихрения. Диффузию можно наблюдать и на бесцветных веществах: влейте тонкой струйкой в высокий стакан с насыщенным раствором поваренной соли дистиллированную воду – обратите внимание, как происходит самоперемешивание раствора. Подобным перемешивание происходит, когда пресная вода рек попадает в солёное море или океан, так рождаются течения.
Однако зачастую мы наблюдаем и химические процессы: гидролиз и сольватацию.
Гидролиз – (греч. «гидрос» - вода, «лизис» - разложение) разрушение веществ под действием молекул воды, наглядный пример – в пробирку с 10 мл воды внесите каплю концентрированного раствора соли серебра, свинца (II), олова (II) или (IV), висмута (III), сурьмы (III) или (V), будете наблюдать помутнение раствора (рис. 2):
SnCl2 + H2O ⇄ Sn(OH)Cl↓ + HCl
Кстати, как видно, уравнение гидролиза иллюстрирует причину изменения окраски индикаторов в растворах данных солей подобно в кислотах. Для многих веществ, образованных сильной кислотой и слабым основанием, гидролиз обратим. Для его предотвращения можно добавить кислоту с соответствующим соли кислотным остатком. Несмотря на противоречие (химики поймут), увеличение концентрации исходного вещества в какой-то момент подавит гидролиз, муть исчезнет и раствор станет насыщенным и бесцветным.
В водных растворах многие вещества образуют так называемые «аквакомплексы». К примеру, сульфат меди (II) CuSO4 – белый порошок, а его кристаллогидрат – пентагидрат сульфата меди (II) или медный купорос CuSO4·5H2O – голубого цвета, а разбавленные растворы солей меди (II)– синие или голубоватые (возьмите тот же зелёный дигидрат хлорида меди (II) CuCl2∙2H2O и разбавьте посильнее водой). Так вот это всё образование аквакомплексов, и тот же купорос можно записать: [Cu(H2O)5]SO4. Другой пример – растворение серной кислоты в воде, вспомните, сколько теплоты выделяется при этом процессе:
H2SO4 + nH2O = H2SO4∙nH2O
При растворении таких веществ (обезвоженные кристаллогидраты, щёлочи, концентрированные кислоты), наблюдается выделение теплоты – экзотермическое растворение. Вот таблица некоторых кристаллогидратов и их безводных солей:
|
Таблица: «Безводные соли и кристаллогидраты» |
|||
|
Безводная
соль (название) |
Цвет
безводной соли |
Кристаллогидрат (название) |
Цвет
кристаллогидрата |
|
CuSO4 cульфат меди (II) |
белый |
CuSO4 ∙ 5H2O пентагидрат
cульфата
меди (II) |
синий (см. фото) |
|
CoCl2 хлорид кобальта (II) |
синий |
CoCl2∙ 7H2O гептагидрат хлорида кобальта (II) |
розовый (см. фото) |
|
NiCl2 хлорид никеля (II) |
грязно-жёлтый |
NiCl2∙ 7H2O гептагидрат хлорида никеля (II) |
салатовый (см. фото) |
|
CuCl2 хлорид меди (II) |
горчичный |
CuCl2∙ 2H2O гептагидрат хлорида меди (II) |
Зелёный (см. фото) |
|
FeSO4 cульфат железа (II) |
бесцветный |
FeSO4∙ 7H2O гептагидрат cульфата железа (II) |
светло-зелёный (см. фото) |
2.
Подготовка к
выполнению эксперимента: что необходимо знать и учитывать

На графике (рис. 3) изображена растворимость некоторых солей в воде. Как показывает практика, наиболее распространёнными веществами для выращивания кристаллов являются: хлорид натрия NaCl, медный купорос CuSO4·5H2O, квасцы (алюмокалиевые KAl(SO4)2·12H2O, хромокалиевые KCr(SO4)2·12H2O и др.). Менее распространены, но также используемы: бихромат K2Cr2O7 и хромат K2CrO4 калия, сульфат железа (II) FeSO4·7H2O, соль Мора (NH4)2Fe(SO4)2∙6H2O, перхлорат натрия NaClO4, красная кровяная K3[Fe(CN)6] и жёлтая кровяная K4[Fe(CN)6] соли, многие соединения тяжелых металлов, органические соединения (гидрофталат калия KHC8O4H4, сахар C12H22O11, салициловая кислота C7H6O3, тиомочевина CS(NH2)2, сегнетова соль KNaC4H4O6·4H2O (натрий-калий винно-кислый или тартрат натрия-калия) и другие различные соли органических кислот).
Границы в этом перечне нет и экспериментировать можно с любыми другими соединениями и растворителем, заменяя воду на легколетучие спирт и эфир. Но, поскольку, самым распространённым растворителем является вода, в экспериментах будет использоваться она, и разговор будет идти, в основном, о соединениях в ней растворимых.
Как правило, при выборе материала важны
следующие факты:
– вещество не должно быть токсичным. Забавно узнать: какие кристаллы, к примеру, даёт сульфид натрия Na2S или цианид калия KCN. Но данные вещества легко окисляются кислородом воздуха и гидролизуются влагой, в результате выделяются токсичные вещества, которые могут привести к отравлению и даже смерти;
– вещество должно быть стабильным. Не должно заметно или необратимо гидролизоваться. Должно быть, стабильно к повышению температуры, так как многие вещества могут разрушаться в горячей воде ( см. гидролиз ), что характерно для некоторых органических веществ; вещество не должно вступать в химическую реакцию со средой (здесь имеется в виду и растворитель, и воздух) или давать с растворителем устойчивую систему, несклонную к кристаллизации. Попытки кристаллизовать гигроскопичные вещества, такие как щёлочи или вещества, которые, находясь в банках, «хватают» влагу из воздуха (соли алюминия, соли железа (III) и др.), тяжело кристаллизующиеся в домашних условиях сахарные сиропы – к успеху не приведут;
– доступность
и приемлемая цена реактивов. Ставьте опыты с теми реактивами, которые
Вам по средствам, не всегда первые опыты удачны, поэтому желательно набивать
руку на недорогих реактивах. Для эксперимента Вам понадобится много дистиллированной
воды (исходный минимум
– вещество должно быть достаточно химически чистым. Как правило, для указания чистоты на этикетке с реактивом пишут: «очищенный» (очищ.) или «технический» (техн.) – самые грязные, но и самые дешёвые. Иногда чего в них только не бывает, на моей практике в таких реактивах попадались пыль, солома, помёт грызунов. Картина при фасовке вырисовалась такая, что некий дядя Вася, куря папиросу, в болотных сапогах совковой лопатой с пола в раздробленном цеху собирал и рассыпал это вещество по баночкам. Далее «ч» - чистый, «чда» - чистый для анализа, «хч» - химически чистый, рекомендуемая и часто используемая марка, «осч» - особо чистый, лучший по чистоте, но самый дорогой. Если Вы не можете найти для опытов дистиллированную воду, то за марками «хч» и «осч» гнаться не желательно;
– способность
вещества растворяться в доступном растворителе. Узнайте, как растворяется
Ваше вещество в воде с изменением температуры на малых объёмах. Пометка
«растворим в воде» не указывает количественный расход вещества. Представьте, например,
если растворимость Вашего вещества подобна растворимости сахара: потребуется
более
– должен быть известен характер растворения вещества. Иногда приходится наблюдать экзо- (с выделением теплоты) или эндотермическое (с поглощением) растворение, и как вследствие этого растворимость вещества будет меняться до тех пор, пока температура раствора не выровняется до комнатной (кстати, помните, что комнатная у всех своя);
–
образующиеся кристаллы должны быть стабильны.
Кристаллы некоторых веществ, вынутые из раствора в течение нескольких минут или
часов способны «выветриваться» -
необратимо разрушаться в результате потери влаги и превращаться в невзрачный порошок.
Это следует помнить при работе с веществами:
- хромокалиевые и железоаммонийные квасцы,
- тиосульфат натрия,
- сульфат натрия,
- соли марганца,
- некоторые соли цинка,
- некоторые соли никеля,
- сегнетова соль,
- жёлтая кровяная соль,
с увеличением температуры в помещении этому подвержены алюмокалиевые квасцы и медный купорос (!). С последними тремя можно подстраховаться – храните кристаллы в дверце холодильника. Но для других веществ требуется хранение в сосудах с притёртыми пробками. Даже бюксы и чашки Петри не защищают кристаллы – печально, но факт. Из перечисленных веществ достаточно длительное время не разрушаются квасцы и медный купорос, но сроки на их стабильность разные, в моём случае происходило разрушение кристалла из-за того, что его догадались положить в бюкс с ватой, чтобы не повредить при перевозке. Медный купорос, тоже ведёт себя по-разному, иногда кристаллы сохраняют некоторую стабильность и лишь со временем местами покрываются белыми пятнами (от полугода до 2 лет), потом разрушение протекает быстро.
Этот неприятный факт может отбить охоту выращивать кристаллы данных веществ. К сожалению, найти приемлемый спасительный способ защиты таких кристаллов я не нашёл. Покрытие бесцветным лаком защищает кристалл на какой-то период времени, но сильно меняет его блеск, а вид кристалла делается искусственным. Затем плётка трескается, если за ней не уследить в этих местах кристалл превращается в пыль и дальше по цепочке. Предположу, что можно было бы такие кристаллы запаивать в изготавливаемых на заказ ёмкостях, но позволить воспользоваться данной технологией может не каждый.
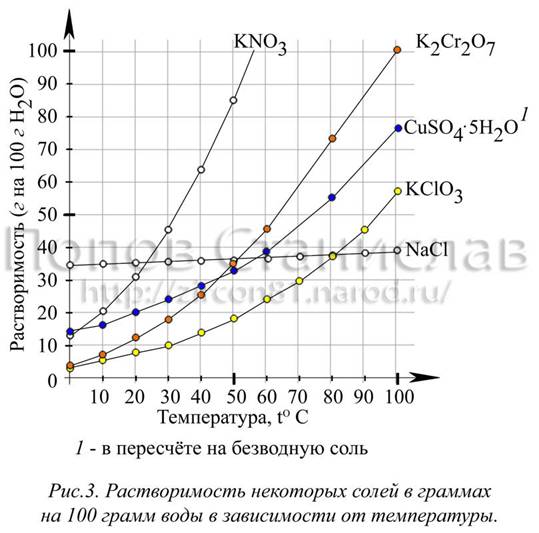
Рис. 4. Выветривание кристаллов.
Пожалуй, самый печальный момент - кристаллы превращаются в прах. Выветривание - разрушение кристаллов в результате «потери» влаги, которая изначально входила в структуру вещества и обеспечивала его прочность.
Бюксы – стеклянные ёмкости с притёртой пробкой на шлифе. Туда помещают кристалл и немного (5-10% от объёма) насыщенного раствора. Их недостаток – попавший на шлиф раствор может намертво «запаять» крышку, и открыть бюкс Вы больше не сможете. К тому же бюксы хрупки и любое изменение внутреннего давления может вызвать образование трещин. Как правило, это место шлифа – муфты и керна, так как последний более тяжёлый и толстый.
Эксикатор – ёмкость созданная изначально для высушивания веществ, хранения в атмосфере какого-либо газа, приготовления очищающей хромовой смеси «хромки» и др., принципы те же, но большие размеры позволят хранить большие кристаллы.

Рис. 5. Бюксы (слева) и эксикатор (справа).
Другой выход – используйте любую ёмкость необходимого диаметра с прозрачными бесцветными стенками и притёртой пробкой. Если пробка резиновая, то для предотвращения от разрушения, оберните её в полиэтилен, фторопласт или целлофан.
Дополнение: кристаллы водорастворимых веществ очень чувствительны к сильным и резким перепадам температур, так как в их составе всегда остаётся какой-то процент влаги, при частых демонстрациях могут появиться сколы и отпечатки пальцев, острые и ровные грани оплывут, кристаллический блеск сменится матовостью, – помните это, если уважаете свой труд. Выращивание кристалла, как и выращивание чего-то живого – долгое и требующее терпения процедура. Научиться растить кристаллы – задача первая, вторая задача – научиться сохранять результат своего занятия.
Требуемое оборудование:
–
химическая посуда – большие термостойкие плоскодонные
стаканы от 0,05 до
– водяная баня (в домашних условиях это м.б. старая кастрюля и электроплита);
–
сосуд для кипячения на водяной бане (круглодонные
термостойкие колбы от
– тонкие, прочные суровые нитки (на таких меньше кристаллических наростов);
– фильтровальная бумага (ёю может быть любая непроклеенная, тонкая бумага промокашка, салфетки, туалетная бумага) или стерильно чистая хлопковая вата;
– дополнительные мелочи, которые требуются при выполнении, будут указаны далее в тексте (воронки (это м.б. срезанное горлышко пластмассовой бутылки); стеклянные, деревянные или пластиковые палочки и т.п.);
Описание методик выращивания кристаллов (из раствора, где растворитель
– вода) можно свести к трём пунктам:
1.
Выращивание больших монокристаллов (длина рёбер от
2. Получение кристаллов мало- или нерастворимых соединений в воде.
3. Получение кристаллов простых веществ (металлов и неметаллов).
3.1.
Выращивание больших
монокристаллов соединений, растворимых в воде
Основой выращивания кристаллов, как описано в любой литературе, является насыщенный раствор соли. Однако здесь есть свои нюансы, которые следует оговорить.
Начинающему экспериментатору рекомендую начать опыт, используя в качестве исходного материала для получения кристаллов: медный купорос, гидрофталат калия, красную кровяную соль, бихромат или хромат калия, алюмокалиевые квасцы (ещё часто в литературе советуют хлорид натрия, но растить его крупные правильные кристаллы труднее (см. рис. 3 и методику в фото)). Крупные кристаллы с этими веществами получаются всегда, другое дело, что может быть неправильно воспроизведена форма (см. рис. 6).
Авторы многих книг по выращиванию кристаллов свои методики основывают:
– на приготовлении пересыщенных растворов с дальнейшей кристаллизацией в открытом сосуде (самая распространённая методика) или закрытом. Закрытый – промышленный метод, для его осуществления используется огромный стеклянный сосуд с термостатом, имитирующим водяную баню. В сосуде находится раствор с готовой затравкой, и каждые 2 дня температура раствора понижается на 0,1оС [4], этот способ позволяет получать технологически правильные и чистые монокристаллы. Но это требует высоких затрат электроэнергии и дорогое оборудование (несколько млн рублей).
– на испарении насыщенного раствора открытым способом (см. ранее пример случайного роста KHSO4), когда постепенное испарение растворителя, например, из неплотно закрытого сосуда с раствором соли, может само собой породить кристаллы. Закрытый способ подразумевает выдерживание насыщенного раствора в эксикаторе над сильным осушителем (оксид фосфора (V) или концентрированная серная кислота).
Я использую первый («открытый») вариант. Да! Это не поможет полностью защитить раствор от пыли (даже накрывая фильтровальной бумагой, используя дистиллированную воду, идеальных стерильных условий для раствора дома Вы не создадите), но Вы и не собираетесь растить кристалл год, верно?! К тому же примеси будут в кристаллах всегда (другие ионы из исходного нечистого вещества или кипячёной воды, пылинки-включения и т. п.), мы можем только слегка уменьшить их содержание. И помните, что идеального кристалла по всем «правилам природы» не существует, дефекты есть даже в очень правильных (однородных) кристаллах.
Ниже речь пойдёт о медном купоросе.
3.2.
Выращивание
монокристалла на примере медного купороса

В каждой методике выращивания можно выделить несколько подпунктов:
- приготовление маточного раствора;
- получение кристалла-затравки;
- выращивание монокристалла.
Примечание: Многие авторы в своих книгах для простоты указывают таблицы
веществ, и сколько их требуется в граммах на приготовление насыщенного раствора
[8]. Я буду использовать «столовую» терминологию Вы, вдруг, скажите: «Точность
никогда не бывает лишней. Скока вешать в граммах?!» А я отвечу: «У большинства
начинающих химиков, экспериментирующих дома, лабораторные весы, как правило,
отсутствуют; во-вторых, точность массы здесь не всегда обязательна, – вещества
может требоваться очень много («комнатная температура» у всех разная), а
определить насыщенность раствора ещё проще – по прекращению растворения
вещества в сосуде». Когда вещество имеется в ограниченном количестве (до
Самое важное условие: для выращивания кристаллов используют только свежеприготовленные растворы!!! Так как в процессе стояния в растворах у многих веществ накапливающиеся определённого состава комплексы (например, аквакомплексы) меняют структуру кристалла (такие кристаллы могут начинать быстрее выветриваться). Какие-то растворы сильно гидролизуются (их ещё можно очистить фильтрованием). В некоторых могут начать процветать случайно попавшие споры грибов (алюмокалиевые квасцы и чаще всего органические вещества).
Прямой способ. Для приготовления маточного раствора требуется
чистый, хорошо вымытый термостойкий стакан на
Возможен и обратный способ приготовления насыщенного раствора. Вы максимально
растворяете вещество при комнатной температуре, и когда растворение достигнет
предела (вещество будет оставаться на дне), добавляете ещё 1-2 порции и греете
сосуд с раствором на плите до t=50-60оС.
Условие этого способа – используемая посуда должна быть термостойкой, а
конфорка плиты ровной, это может создать неудобство при нагревании объёмов,
например, в
Примечание: Экспериментатору следует знать, что любая примесь в
растворе может стать включением в кристалле или быть источником дефекта. В
итоге вместо монокристалла появятся «химеры», состоящие из наростов и искажений
(это возникшие из-за разных центров кристаллизации микрокристаллики пробуравили
друг друга); они будут увеличиваться по мере роста кристалла. Иногда это
выглядит более эффектно, чем правильный монокристалл (вырастить который,
кстати, задача сложная). Но помните, всякое отклонение следует расценивать, как
не соблюдение каких-либо условий. В природе попадающие примеси становятся
включением в кристалле и иногда не искажают его форму: рост одних минералов в
других, явление изоморфизма для квасцов (рис.
7), насекомые, попавшие в воду и закристаллизовавшиеся там (например, град)
и т. п.
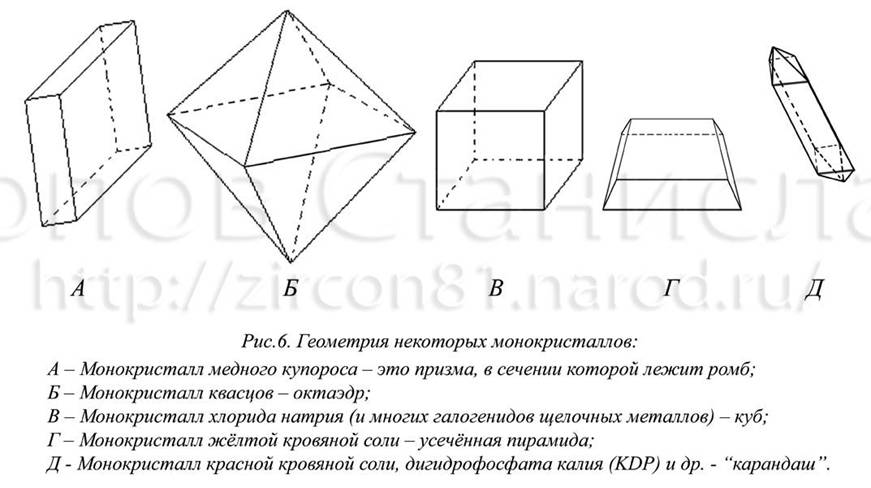
Рис. 7. Изоморфизм.
«Кристалл в кристалле» - такое выращивание, когда один кристалл растёт поверх затравки другого кристалла, можно осуществлять с веществами одинаковой природы, например, с квасцами общей формулы
MeIMeIII(SO4)2∙12H2O (MeI= щелочной металл и NH4+, MeIII=Al3+, Cr3+, Fe3+ и др.)
На следующий день осматривают
раствор. В нём не должны плавать примеси; если это раствор алюмокалиевых
квасцов, то он должен быть бесцветным и прозрачным. Раствор же медного купороса
не должен содержать мути. На дне должен
выпасть избыток вещества в виде кристаллов. В том случае, если обнаружены
примеси, раствор подогревают на 20оC (поставьте стакан с раствором в таз с
тёплой водой на 1-2 часа) и фильтруют на воронке, внутрь которой помещают
фильтр или (что быстрее и лучше) кусочек ваты. Поскольку нам осадок не нужен,
зачем усложнять процесс фильтрования. Кусочек ваты должен лежать неплотно на
дне воронки, не затруднять ток жидкости, но и не проваливаться с нею в стакан,
иначе фильтровать придётся заново, смачивать вату водой, как фильтр не надо.
Затем повторяют охлаждение до комнатной температуры. Этот раствор будет необходим
нам в большом количестве, поэтому вы должны иметь посуду для его хранения и по
необходимости запастись им дополнительно. Хранить его можно в колбе, либо
пластиковых бутылках из-под воды, не содержащей красителей и ароматизаторов
(объём которых варьирует от 0,33 до
II. Получение кристалла-затравки:
Готовый очищенный раствор
аккуратно сливают с осадка кристаллов и в количестве
Резкий перепад температур, как
и резкое перемешивание остывшего раствора, могут вызвать преждевременную
кристаллизацию, но кристаллы при этом получатся мелкие и бесформенные, они
плотно осядут на стенках раствора и нагревание придётся повторять снова.
Спустя сутки, убирают полотенце, не стараясь колыхать стакан, чтобы не вызвать незапланированную кристаллизацию. Осматривают содержимое – на дне и на стенках должны образоваться небольшие плоские синие кристаллики-параллелограммы.
– Если образовалось множество мелких сросшихся бесформенных кристалликов, как после резкого охлаждения, то количество соли уменьшают и повторяют описанную стадию.
– Если кристаллики не образовались, Ваша вина – Вы не насытили раствор как следует и поэтому раствору следует постоять ещё сутки; либо следует увеличить количество растворяемого вещества, повторив этап заново.
Эта стадия эксперимента должна
вас обучить правильно выращивать затравку, которая далее будет исходным
кирпичиком для получения «огромной конструкции». Отберите подходящие по
структуре кристаллики (с длинной ребра от
Помните: чем меньше выбранная вами затравка, чем она правильнее, тем легче раствору (системе) подстроиться под неё (как перламутру к песчинке, попавшей в мантию моллюска).
III. Выращивание монокристалла:
Монокристалл выращивают из
полученной затравки. Используя суровую нить, плотно на 1-2 раза обвивают
затравку, чтобы она не соскользнула после намокания нити, желательно за самую
длинную грань, либо выберите затравку с длинной гранью. Придётся помучиться, создавая петельку, в
которую ляжет кристалл размером около 3-
Снова готовят насыщенный раствор на основе исходного маточного. Для этого готовый раствор ставят на водяную баню и добавляют 0,5 чайной ложки вещества (иногда меньше). Чем меньше Вы добавите его на этом этапе, тем лучше (можно также просто нагреть насыщенный раствор, без добавления вещества). Греют и перемешивают. Как только вещество растворилось, колбу вынимают, и раствор переливают в заранее приготовленный нагретый стакан. Стакан с раствором ставят на выбранное место, и дают 20-30 секунд постоять, чтобы жидкость немного успокоилась. Наш раствор непересыщенный, поэтому «лишние градусы» могут вызвать растворение затравки, что нам не нужно. Если раствор тёплый, ему дают остыть до 30оC или чуть меньше. Желателен термометр, но проверить при его отсутствии приблизительную температуру – легко, температура нашего тела 36,6оC, поэтому всё, что кажется теплее – выше её, наоборот – ниже. Следить за остыванием раствора следует очень внимательно, чтобы не допустить её понижения до комнатной (обычно на остывание раствора выделяю около двух часов, в зависимости от температуры воздуха в помещении). Затем затравку располагают в тёплом растворе (температура на 5-7оС выше комнатной) таким образом, чтобы кристаллик как бы висел в нём, на высоте1/2 или 3/5 от дна. Поместив затравку в раствор, понаблюдайте на просвет не оплывают ли грани у Вашей затравки, не создаются ли вокруг неё волнообразные завихрения. Если да – раствор ещё тёплый для затравки, такое бывает с хорошо растворимыми в воде веществами, надо затравку вынимать и подождать ещё. Мой обычный температурный предел выжидания: раствор должен быть минимум на 5оС выше комнатной температуры. Когда, наконец, разместили – всё, осталось только ждать, при этом стакан вертеть, наклонять, перемешивать раствор не рекомендуется.
Бывает и такое: пришли на утро смотреть на затравку, а в растворе только петля болтается и затравка лежит на дне. Если нить была толстая, она набухла, петля увеличилась и кристалл выпал. Но стоп, трогать, вынимать что-либо, а уж тем более расстраиваться не нужно! Читайте ниже.
Следует сказать, что можно вырастить кристалл и без нити. Для этого требуется широкий стакан с плоским дном, так как для этой цели затравку аккуратно укладывают на середину дна (можно помочь ей лечь нагретой стеклянной палочкой), и она повторит его рельеф. Здесь рост кристалла будет ограничен стенками стакана, и преимущественно, он будет расти в стороны – это хорошо для медного купороса и для плоских кристаллов в принципе (жёлтая кровяная соль, гидрофталат калия). Если такое получилось случайно, следите, чтобы на дне не стали расти ещё кристаллы, а то они врастут в исходный. На петле со временем тоже могут начать расти кристаллы, иногда их бывает несколько, а иногда растёт 1-2 правильных и выросшие таким образом, они окажутся лучше затравки.
В случае с квасцами лучше использовать нить. Но здесь требуется следить за тем, чтобы она не обрастала. Если такое произошло, то нить с кристаллом вынимают, счищают лишнее и заново готовят раствор1 (греют, подготавливают к температуре кристалл и т.п.) Порой нить трудно очищать, соскабливая лишние кристаллические наросты, высок риск её разорвать. Для этого надо поднести нить к тонкой струе горячей воды, и поводить «проблемный» участок так, чтобы вода не задела затравку до их растворения.
Помните: чтобы не было наростов на нити, нить должна быть тонкой без волосков, и должна быть опущена с затравкой в раствор на 5-7оС теплее комнатной температуры. Такая нить успевает пропитаться раствором и «сливается» с системой в единое целое. О.Ольгин советует смазать нить вазелином [1], но мне это не помогало, при этом часто загрязнялся раствор маслянистой плёнкой. Но я не спорю с идеей, в своей книге «Опыты без взрывов» он не преследует целей вырастить крупный однородный кристалл, а жаль…
Затравку иногда советуют
прилеплять супер-клеем, лично я не пробовал.
Теперь следует следить за ростом кристалла каждый день, ни в коем случае не поднимая, не поворачивая и не сотрясая стакан с раствором, иначе эта встряска породит в системе незапланированную, иногда мгновенную кристаллизацию.
Так многие авторы советую доливать
раствор в систему по мере его испарения. Для небольших объёмов очень сложная
операция, поскольку возникшая сильная диффузия также может вызвать сбои в росте
кристалла. В насыщенную систему растворы я не доливаю, я готовлю большой объём
вещества сразу и выращиваю кристаллы в стаканах от
Вначале вы увидите, как система будет «обживать» затравку, как они будут подстраиваться друг под друга. По мере роста нить начнёт уходить внутрь кристалла, получится что-то вроде кулона. В итоге вы должны получить следующее:

Рис.8. Выращенные кристаллы медного купороса (I) и алюмокалиевых квасцов (II)2, один кристалл - за одну неделю.
Как видите, у кристаллов есть своя особенность, они должны быть гладкими и прозрачными, как стекло. Однако, при частом прикасании к кристаллу, хранении на открытом воздухе, на свету, мы наблюдаем его помутнение: кристалл выветривается, т.е. теряет, всегда входящую в его состав воду. Есть несколько веществ, которые в моей практике превосходно сохранились и не потеряли вошедшую в их состав воду: гидрофталат калия, красная кровяная соль, хлорид натрия. Вода в кристалл входит в разных количествах и в красной кровяной соли, алюмокалиевых квасцах, к примеру, она удерживается лучше, чем в жёлтой кровяной соли и в хромокалиевых квасцах. Избежать выветривания для кристаллов, выращенных из растворов, сложно. Поэтому хранить кристаллы следует в герметичных пакетах или баночках в холодильнике (см. ранее). Хромокалиевые квасцы лучше хранить в концентрированном сотрясённом растворе в банке с плотно прилегающей пробкой в месте, где температура может измениться максимум на 5о.
Более подробная информация о росте кристаллов представлена на отдельной ссылке рядом с их фотографиями.
Примечание:
1). Некоторые кристаллы (гидрофталат калия) можно выращивать, погрузив
только один раз в раствор, в слегка тёплых растворах. При высокой (или наоборот
– низкой) температуре кристалл покрывается трещинами и мутнеет. Идеальный
кристалл гидрофталата калия – шестиугольная
призма-таблетка, прозрачная как стекло. Если вы посмотрите на химическую
формулу (рис.9), которая отражает его состав, вы поймёте, почему у кристаллов
такая форма:

Рис.
9. Гидрофталат калия (С8Н5О4К).
2). Очень часто, вместо идеального
октаэдра (т.е. тетрагональная бипирамида) у квасцов получается усечённый
октаэдр – кубоктаэдр. Поэтому обращайте внимание на выбор затравки (кристалл
создаётся по подобию затравки), тупая грань повториться везде! Так устроена
система: она влияет на рост кристалла и сам кристалл влияет на свой рост.
3).Выращивание кристаллов хромокалиевых квасцов сопряжено с трудностями:
во-первых, раствор не прозрачен, во-вторых, полученные кристаллы можно хранить
только под слоем раствора при постоянной температуре или под толстым слоем лака
(бесцветный лак для ногтей) в холодильнике. Однако смеси полученные при
смешении растворов алюмокалиевых и содержащие от 5% до 30% хромокалиевых
квасцов дают растворы различного оттенка от нежно-розового до цвета аметиста и
граната, выращенные из них кристаллы, также имеют форму октаэдра, и хранятся
намного дольше хромокалиевых без какой-либо защиты.
4).
При выращивании кристаллов бихромата калия, в раствор добавляют немного
хромового ангидрида CrO3 (количество его приходится угадывать на практике),
полученные кристаллы не совсем отвечают формуле K2Cr2O7, скорее
формуле K2Cr3O10 (трихромат калия), и имеют вид ярко-красных и почти
коричневых параллелепипедов. А вот для роста K2CrO4 подобные условия излишни, да и кристаллы у хромата
калия – гексагональные бипирамиды.
5).
Очень дорогая сегнетова соль может дать прозрачные кристаллы-цилиндры до
6).
Ромбические призмы, подобные медному купоросу дают тиосульфат натрия (фиксаж) и
сульфит натрия, полученные кристаллы похожи на лёд, однако не стабильны и на
воздухе рассыпаются в белый порошок спустя несколько часов. Хранение подобно
хромокалиевым квасцам, но под лаком кристалл также мутнее.
7).
У хлорида натрия можно вырастить небольшие кубики, для получения крупных
кристаллов используют большие сосуды с затравками, поскольку растворимость его
меняется слабо. Более другой, эффективный способ – выращивание из концентрированного
раствора хлорида меди (II) CuCl2,
который, испаряясь, высаливает в первую очередь хлорид натрия. Однако полученные
кристаллы имеют зелёный оттенок. И второй вариант – добавление к раствору соли
мочевины (на 200 мл насыщенного
раствора 3 ч/ложки карбамида) – эту методику предлагали в своей книге Кантор Б. З.; "Минерал рассказывает о себе",
М.: Недра,
8). Иногда можно наблюдать и такой процесс. В
насыщенном растворе с кристаллами на дне всегда существует круговорот: вещество
из кристаллического осадка переходит в раствор и обратно. Каждый раз
«возвращаясь» в кристалл вещество его укрупняет, так спустя несколько месяцев,
мелкокристаллический осадок превращается в крупнокристаллический монолит, которые
может дилетантами восприниматься как один большой кристалл.
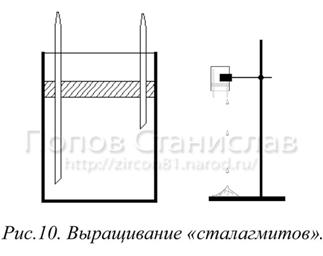
 9). Вы также можете вырастить свои «сталагмиты» и
«сталактиты» (Л. Г. Катаева, г.
Сосенский, Калужская обл.). Для этих целей готовят очень пересыщенные
растворы тиосульфата натрия Na2S2O3*5H2O или
ацетата натрия CH3COONa. Их наливают в заранее приготовленные стаканы
(рис.10) со стеклянными трубками разной длины (трубки должны быть тонкими,
чтобы раствор через них капал!), заливают парафином (слой
9). Вы также можете вырастить свои «сталагмиты» и
«сталактиты» (Л. Г. Катаева, г.
Сосенский, Калужская обл.). Для этих целей готовят очень пересыщенные
растворы тиосульфата натрия Na2S2O3*5H2O или
ацетата натрия CH3COONa. Их наливают в заранее приготовленные стаканы
(рис.10) со стеклянными трубками разной длины (трубки должны быть тонкими,
чтобы раствор через них капал!), заливают парафином (слой
Я
предлагаю заменить данный прибор хорошо отрегулированной капельной воронкой, в
которую доливать насыщенный раствор по мере его расходования удобнее. Авот
некоторые ребята могут получить такой сталактит за несколько секунд, жаль, что
временя этот результат сохраняет ненадолго. В химии опыты с ацетатом натрия известны,
как «горячий лёд»:
9).
Игольчатые, пушистые кристаллы камфары или салициловой кислоты длиной 0,3-
 10). Если приготовить раствор хлорида аммония NH4Cl небольшой концентрации (40-50%) и кистью нанести на
чистую стеклянную пластину, то при высыхании получится «морозный узор», такие
узоры могут дать и любые другие вещества, если работать с их разбавленными
растворами.
10). Если приготовить раствор хлорида аммония NH4Cl небольшой концентрации (40-50%) и кистью нанести на
чистую стеклянную пластину, то при высыхании получится «морозный узор», такие
узоры могут дать и любые другие вещества, если работать с их разбавленными
растворами.
11).
Если из нержавеющей проволоки или спичек сделать буквы, их плотно обмотать
ниткой и поместить в раствор для выращивания кристаллов, то можно получить
красивые буквы для оформления стендов. Их вынимают из раствора, сушат и покрывают
бесцветным лаком или клеем для склеивания пластмасс. Рекомендуемые соли: поваренная
соль, хромат и бихромат калия, квасцы. А вот кристаллическая мебель (рис. 11) –
пример того, что будет, если не мыслить размерами стакана и оценивать возможности
нитки:
http://www.novate.ru/blogs/131008/10496/
3.3.
Получение
кристаллов малорастворимых или нерастворимых соединений в воде
 Самый
простой пример таких солей – это готовый иодид свинца, растворимость которого
(ПР=8,7·10-9; s=0,0013
г/мл) возрастает с нагреванием.
Самый
простой пример таких солей – это готовый иодид свинца, растворимость которого
(ПР=8,7·10-9; s=0,0013
г/мл) возрастает с нагреванием.
ПР[PbI2]=[Pb2+][2I–]2=4s3
ПР – произведение растворимости;
s – растворимость (г/мл);
Однако пытаться приготовить насыщенные растворы нерастворимых соединений для получения огромных кристаллов зачастую бесполезное занятие. Нужны термостаты.
Но вы спросите: «Ну, как-то же
они растут в природе, например, кальцит CaCO3, барит BaSO4». Вот именно, что «в природе», а там свои
лабораторные условия, свои давление и температура. Попрошу вас приготовить
раствор угольной кислоты, – удастся вам это сделать? А представьте себе, что
происходит с CO2,
CaCO3 на
глубине 20-
H2O + CO2 ⇄ H2CO3
H2CO3 + CaCO3↓
→ Ca(HCO3)2
Попробуем же максимально приблизиться к природным условиям выращивания, но при наших tоС и P,атм. Однако, кристаллы, подобные медному купоросу, здесь никто не обещает.
Для опыта нам потребуется
большой стеклянный стакан (около 1 литра) или аквариум (объём 3-
Pb(NO3)2 + 2KBr (KI, KCl) → PbBr2↓(PbI2, PbCl2) + 2KNO3
Pb(NO3)2 + 2K2SO4
→ PbSO4↓ + 2KNO3
BaCl2 + Na2S2O3
→ BaS2O3↓ + 2NaCl
CaCl2 + 2NaOH → Ca(OH)2↓ + 2NaCl
CaCl2 + Na2CO3
→ CaCO3↓ + 2NaCl
В большой стакан (аквариум)
помещают стаканы малого объёма (удобны аптекарские пенициллиновые пузырьки), в которых
находятся концентрированные растворы исходных солей с небольшим количеством
соли (1/6 часть) на дне, на расстояние друг от друга 5-
Уже спустя 2-3 дня Вы заметите
появление следов осадка возле одного из пузырьков (процесс диффузии), а спустя
неделю, на отверстии пузырька появится что-то напоминающее кристалл. У хлорида
свинца, карбоната кальция это будут длинные игольчатые кристаллы, у иодида
свинца – стружки и плитки (рис. 12).
По мере расхода концентрированного раствора соли в пузырьке, будет
расходоваться заранее положенный избыток. Чем дальше будут удалены пузырьки в
сосуде, чем больше будет сосуд, тем больше вероятность создать условия для
медленного роста «большого кристалла». Но повторюсь, идеальный монокристалл с
ребром даже
Примечание:
1). Нами
создаются неидеальные природные условия, так как у природы ещё фигурирует
давление и время. Вы ни за что не получите таким образом малахитовые (CuOH)2CO3 пласты с соответствующим узором, бесцветный
прозрачный исландский шпат CaCO3, имеющий вид скошенного куба. Опыты следует проводить
только с теми веществами, ПР (произведение растворимости) которых не меньше 10-10.
А для получения искусственного малахита необходим гидротермальный синтез (от
греч. «гидро» – вода и «термос» – горячий) Этот процесс моделирует образование
минералов в земных недрах. Он основан на способности воды растворять при высоких
температурах (до 5000С) и очень высоком давлении (до 3000 атм)
вещества, которые в обычных условиях практически не растворимы, например,
основной карбонат меди (CuOH)2CO3.
2). То, что водные растворы,
отличающиеся по плотностям, перемешиваются медленно, иллюстрирует и природный
пример – солёные морские и океанические озера, возникающие глубоко на дне морей
и океанов.
3.4.
Получение
кристаллов простых веществ (металлов и неметаллов)
Здесь не пойдёт речь о методах зонной плавки или иодного рафинирования, которые используются для получения сверхчистых монокристаллов простых веществ (германия Ge, кремния Si, циркония Zr, титана Ti и др.).
Выращивать кристаллы металлов мы будем из раствора. И, конечно же, это будут металлы неактивные и малоактивные, невзаимодействующие с водой (медь, сурьма, висмут, серебро, золото, свинец, олово и т.п.). Да, свинец, особенно, если вода насыщена углекислым газом, постепенно растворяется, вспомните из истории последствия римского водопровода. Описание опыта будет иллюстрировано на примере выращивания кристаллов меди.
Для эксперимента нам понадобится медный купорос (тв.), хлорид натрия (тв. и конц. р-р), дистиллированная вода, стакан (от 50 мл до 700 мл) или обычная пробирка, фильтровальная бумага, железные скрепки, кнопки и т.п.
Начинающему можно посоветовать для начала попробовать провести опыт в пробирке объёмом 50 мл. Так он поймёт немного суть процесса и получит первый навык.
Если вы опустите железный гвоздь в стакан с медным купоросом, то он мгновенно покроется розовой плёнкой, состоящей из очень мелких кристалликов восстановленной меди. Такая плёнка легко стирается и особого интереса не представляет, а дальнейшее содержание железа в растворе даст губчатую медь, а не кристаллы. Для получения кристаллов нужно создать среду-ингибитор, такой средой в нашем случае будет хлорид натрия.
В чистый стакан (рис.13)
насыпают медный купорос очень тонким слоем (около
|
|
Рис.13. Выращивание кристаллов меди. 1 – фильтровальная
бумага; 2 – водород; 3 – насыщенный при
комнатной температуре раствор хлорида натрия; 4 – слой из железных
предметов; 5 – слой хлорида
натрия NaCl; 6 – пузырьки воздуха,
которые следует удалить; 7 – слой медного
купороса CuSO4∙5H2O; |
|
Рис. 14. Выращивание кристаллов меди. |
|
Спустя пару суток (а иногда это видно в первые минуты) слои солей окрасятся в зелёный цвет, это, очевидно, связано с образованием в слоях хлорида меди (II) CuCl2. После того, как «зелень» дойдёт до фильтра, начнут появляться в слое хлорида натрия розовые нити-дендриты (не сформировавшиеся кристаллы) меди, которые иногда приобретают удивительный вид папоротниковых и еловых веточек (рис.16,б). Если дать им разрастись, то вскоре вы получите обещанные ярко-розовые кристаллы меди (рис.16,а), имеющие вид призм и октаэдров.
Из-за гидролиза соли – в растворе среда кислая и параллельно происходит растворение железа с выделением горючего водорода. Атомарный водород успевает восстановить присутствующие в железе примеси, например углерод до какого-нибудь углеводорода. Часто углеводороды образуются из-за разложения карбидов железа, которые присутствуют в стальных изделиях. При этом водород имеет мерзкий запах. Помните: такой водород вдыхать опасно!!! Если вы решили использовать вместо железа технический цинк, то реакция пойдёт хуже, но здесь опасность другая: в техническом цинке, например, может содержаться мышьяк, который восстановиться водородом до сильнейшего яда – арсина AsH3.
|
Таблица 3.4. Возможные
химические реакции при выращивании кристаллов меди в системе CuSO4∙5H2O/NaCl/Fe |
|||
|
№ |
Молекулярная химическая реакция |
Тип реакции |
Наблюдаемые изменения |
|
1 |
2CuSO4 + 2H2O ⇄ (CuOH)2SO4↓
+ H2SO4 |
реакция обмена (гидролиз) |
|
|
2 |
CuSO4 + 2NaCl ⇄
Na2SO4
+ CuCl2 |
реакция обмена |
позеленение слоёв солей |
|
3 |
CuCl2 + H2O ⇄ Cu(OH)Cl↓ + HCl |
реакция обмена
(гидролиз) |
|
|
4 |
CuCl2 + Fe = FeCl2 + Cu↓ |
реакция замещения |
рост кристаллов меди |
|
5 |
4Fe + 2O2 + 6H2O = 4Fe(OH)3 |
реакция соединения |
ржавление железа |
|
6 |
FeCl2 + H2O ⇄ Fe(OH)Cl↓ + HCl |
реакция обмена
(гидролиз) |
|
|
7 |
4Fe(OH)Cl + 2H2O + O2
= 4Fe(OH)2Cl↓ |
реакция соединения |
бурение раствора |
|
8 |
Fe + H2SO4 = FeSO4
+ H2↑ |
реакция замещения |
выделение пузырьков газа |
|
9 |
Fe + 2HCl = FeCl2 + H2↑ |
реакция замещения |
выделение пузырьков газа |
|
10 |
Cu + CuCl2 = Cu2Cl2↓ |
реакция соединения |
|
|
11 |
2FeSO4 + 2H2O ⇄ (FeOH)2SO4↓
+ H2SO4 |
реакция обмена
(гидролиз) |
|
|
12 |
4FeSO4 + 2H2SO4 +
O2 = 2Fe2(SO4)3 + 2H2O |
|
бурение раствора |
|
13 |
Fe2(SO4)3 +
2H2O ⇄ 2Fe(OH)SO4↓+ H2SO4 |
реакция обмена
(гидролиз) |
|
|
14 |
4FeCl2 + 4HCl + O2 = 4FeCl3
+ 2H2O |
|
бурение раствора |
Этот перечень можно ещё продолжать и продолжать (хотя бы только на одних реакциях гидролиза). Додумайте сами, какая химическая реакция вызывает почернение, возникающее со временем вокруг кристаллов, и что за вещество бледно-жёлтого цвета заменяет слой с купоросом.
В такой системе кристаллы могут расти несколько дней, недель и даже месяцев, зависит от размеров сосуда, но если слои стали чернеть, кристаллы следует вынуть.

Рис. 15. Кристаллы меди.
Когда вы решите вынуть кристаллы, то:
– сначала магнитом удаляют оставшееся железо;
– аккуратно сливают раствор;
– пинцетом удаляют остатки фильтра;
– пинцетом и пластмассовой ложкой выгребают слой хлорида натрия и кристаллы меди в чистый, заранее приготовленный стакан;
Затем кристаллы несколько раз заливают тёплой водой, чтобы растворить хлорид натрия. Когда соли не останется, а промывочный раствор будет прозрачен, кристаллы промывают 30%-ным раствором серной кислоты. Раствор с кристаллами меди можно подогреть до 50оС, чтобы скорее растворить возможные оксиды, так как недопустимо хранение меди в серной кислоте (даже разбавленной) в присутствии её соединений. Хранят кристаллы в растворе серной кислоты той же концентрации в стеклянной банке с притёртой пробкой под очень тонким (по возможности) слоем воздуха. Хорошо, если перед хранением раствор кислоты продуть водородом или азотом, можно также выбрать мерную аналитическую колбу, у них горлышко сильно сужается и воздуха над раствором остаётся меньше. На воздухе кристаллы не устойчивы, теряют яркий розовый блеск и разрушаются.
В природе медь растёт таким же образом, но ингибитором здесь являются дерево, кварц (рис.16,в).
|
|
||
|
а). |
б). |
в). |
|
Рис.16.
Искусственно выращенные (а, б) и
природные (в) кристаллы меди. |
||
Примечание:
1.
Подобным образом растят кристаллы серебра, висмута, сурьмы, только исходные
вещества – нитраты, а в случае серебра, соли которого светочувствительны,
реакцию следует проводить в темноте или при красной лампе. Иначе выращивают
кристаллы свинца и олова, ингибитор заменён подкисленным раствором соли одного
из этих металлов малой концентрации.
2.
В основу образования кристаллов меди положены процессы гидролиза, реакций
обмена и замещения. Ионы меди Cu2+ в растворе будут более подвижны, чем сульфат-ионы SO42-. Поэтому происходит обмен между верхним и нижним
слоем солей, в ходе которого образуется зелёный хлорид меди. В свою очередь,
достигая железа, ионы меди восстанавливаются до металла. Кристаллики, срастаясь
в слое хлорида натрия, образуют сначала розовые нити (дендриты), а потом сами
кристаллы. Поскольку при гидролизе солей меди появляются ионы H+, то и
они в свою очередь восстанавливаются железом до водорода H2.
Содержащийся в воздухе кислород также способствует его коррозии. В итоге,
конечные продукты: сульфаты железа и натрия, хлорид натрия (его мы брали в избытке),
гидроксид железа (III), хлориды меды (I) и (II), водород и
само собой – медь. Но есть и ещё один продукт, который мы можем уловить только
носом. В железе, в его сплавах (сталь), как правило, присутствует углерод и
карбиды, которые в свою очередь дадут углеводороды.
3.
При желании можно получить и другие кристаллы: клатратов хлора Cl2*(7+x)H2O (замораживание
влажного хлора, либо продувка хлора через снег), серного ангидрида (III) SO3, йода I2 (возгонка и осаждение на холодную поверхность),
ромбической серы Sa (кристаллизация
из сероуглерода, ацетона, хлороформа), моноклинной серы Sb (постепенное охлаждение расплава).
4.
При испарении раствора золота в ртути можно получить октаэдрические кристаллы
золота [6]. Но стоит помнить, что ртуть опасна в виду сильной токсичности её
паров. И наличие металла во вдыхаемом человеком воздухе грозит в будущем кучей
заболеваний, к примеру «ртутным тремором».
5.
А вот кристаллы металлов, которые были выращены под действием электрического
тока: «Металлы,
полученные электролизом»
Остаётся только
добавить, что список получения кристаллов очень большой, а количество методик
также немало. Лучшей методикой останется та, которая поможет Вам на практике
добиваться наилучшего результата, а основой ей станет в первую очередь Ваш
опыт, терпение и желание добиваться с каждым разом совершенства в своей работе.
На
этом – всё.
Буду
рад, если Вы мне напишите о своих результатах или предоставите дополнительную
информацию по выращиванию кристаллов, отсутствующую здесь.
Желаю удачи в эксперименте!
1. Ольгин О., «Опыты без взрывов», М.; «Химия», 1995г.;
2.
Верховский В. Н., «Техника и методика химического
эксперимента в школе», Л.; УЧПЕДГКЗ, 1 том
3. Здорик Т. Б., «Камень, рождающий металл», М.; «Просвещение», 1984г.;
4. Шаскольская М. П.; "Кристаллы", М.: Наука, 1985г.;
5. Кантор Б. З.; "Минерал рассказывает о себе", М.: Недра, 1985г.;
6. Стёпин Б. Д., Аликберова Л. Ю., "Книга по химии для домашнего чтения", М.: Химия, 1994г.;
7. Полосин В. С.; "Школьный эксперимент по неорганической химии", УЧПЕДГИЗ, 1959г.;
8. Алексинский В. Н.; "Занимательные опыты по химии", М.: Просвещение, 1995г. (только как указатель на литературу по выращиванию кристаллов)




